朋友们,你们知道为什么美国的医疗器械注册叫做510k这个问题吗?如果不了解该问题的话,小编将详细为你解答,希望对你有所帮助!
关于FDA认证的问题,是不是说有了510(k)或PMA就等同于有了FDA认证?_百度...
1、K不等同于FDA,只在一些特定的条件下才必须申请 食品、药品和化妆品(FD&C)行动委员会和21CFR807的510(k)规章中并没有特别指出谁必须申请510(k)---任何人都可以申请。
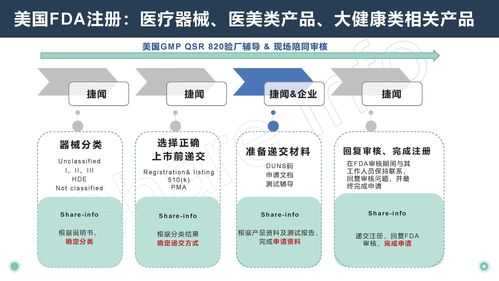
2、510(k)预先市场通知:对于类似已获得FDA批准的现有设备或产品,可以通过提交510(k)预先市场通知来申请认证。该程序要求提供有关产品的详细信息和证明材料,以证明其与已获批准产品的相似性。
3、FDA认证:美国食品和药物管理局简称FDA,FDA是美国政府在健康与人类服务部(DHHS)和公共卫生部(PHS)中设立的执行机构之一。
口罩510k是什么认证?
1、and Drug Administration)简称FDA,FDA 是美国政府在健康与人类服务部 (DHHS)和公共卫生部 (PHS)中设立的执行机构之一。
2、根据查阅该公司医用外科口罩产品于近日取得美国食品药品监督管理局(FDA)510K医疗器械认证。大力生产n95口罩。
3、出口至澳大利亚TGA认证,此外,您还需要确保您的企业在中国商务部的白名单内。
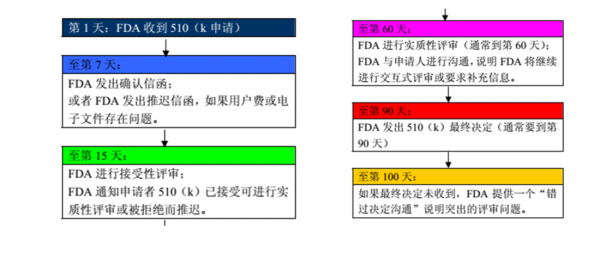
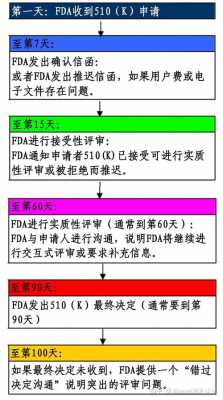
4、k文件是向FDA递交的上市前申请文件,目的是证明申请上市的器械与不受上市前批准(PMA)影响的合法上市器械同样安全有效,即为等价器械(substantially equivalent)。
fda510k认证是什么意思
FDA510(k)认证是美国食品药品监督管理局对某些医疗器械进行市场准入审查程序。制造商在想要销售新型医疗器械时,需要获得FDA批准或许可。
k是美国食品药品监督管理局(FDA)对某些食品、药品及医疗器械的市场准入要求之一。本文将简要介绍510k的概念、申请流程和目的。
老梁告诉你什么是FDA:FDA在美国乃至全球都有极其巨大的影响,有“美国人健康守护神”之称。
FDA是一个由医生、律师、微生物学家、药理学家、化学家和统计学家等专业人士组成的致力于保护、促进和提高国民健康的政府卫生管制的监控机构。通过FDA认证的食品、药品、化妆品和医疗器具对人体是确保安全而有效的。
美国FDA资料中提到的K号是什么意思
1、FDA 实际上相当于产品认证,就是国内的产品注册证。虽然这样对比不太正确,但是对于你理解 比较容易。有了510K 的号码就是通过了FDA的认证,就可以在美国市场自由销售。
2、k是没有“有效期”这个说法的,只要求企业每年定期进行注册信息的更新。
3、申请。基于指定的行为,必须向FDA递交510(k)的如下所示:(1)把器械引入美国市场的国内厂家;如果成品器械厂家根据他们自己的规定装配器械,并在美国上市,那么必须递交510(k)。
4、美国食品和药物管理局简称FDA,FDA是美国政府在健康与人类服务部(DHHS)和公共卫生部(PHS)中设立的执行机构之一。
5、FDA检测:就是按照FDA法规对产品进行测试,比如医疗做510K 美国食品和药物管理局(Food and Drug Administration)简称FDA, FDA 是美国政府在健康与人类服务部 (DHHS) 和公共卫生部 (PHS) 中设立的执行机构之一。
医疗器械国外注册的法规要求?
1、FDA-医疗器械法规要求 FDA要求所有从事生产、配制、传播、合成、组装、加工或进出口医疗器械的企业在向美国出口前,必须在FDA进行注册。获得有效的注册号码。
2、医疗器械FDA510(K) Exempt注册:包括企业注册和产品列名两个部分。注册完成后输入相应的注册码、查询码、或者企业名称可以到FDA官网上查询到相关信息。费用包括两个方面。
3、FDA要求,所有从事生产、加工、包装和销售医疗器械的企业必须在FDA进行注册,获得有效的注册号码;同时,产品还需要在FDA进行产品列名(Device Listing),获得有效的列名号码后方可出口美国。
小伙伴们,上文介绍为什么美国的医疗器械注册叫做510k的内容,你了解清楚吗?希望对你有所帮助,任何问题可以给我留言,让我们下期再见吧。

 微信扫一扫打赏
微信扫一扫打赏