大家好!小编今天给大家解答一下有关豁免临床目录什么意思,以及分享几个豁免临床试验目录对应的知识点,希望对各位有所帮助,不要忘了收藏本站喔。
医保报销的目录是什么
1、医保报销的三目录指的是药品目录、诊疗项目目录和服务设置目录。第一个目录是药品目录,也就是哪些药是可以报销的。药品目录分为甲类、乙类和丙类药物,其中甲类药物是属于临床广泛使用,疗效好、价格低的药。

2、基本医疗保险药品目录 诊疗项目目录 医疗服务设施目录这三大目录就是我国医保政策执行和报销的最基本的准则。
3、医保报销药品目录是由国家医保局发布的,其主要分为基本药物目录和药品目录两部分。基本药物目录是政府制定的最基本、最经济、最有效的治疗必需药物清单,旨在保障人民基本医疗用药需求。
4、作为一项惠民政策,医保报销可以很大程度上减轻参保群众的经济负担,不过医保报销是有范围的,医保部门规定了基本医疗保险药品目录、诊疗项目和医疗服务设施的报销范围,俗称“三个目录”。
如何申请豁免临床试验
1、如果是国内注册的话,要看该器械是否在豁免名单内,否则就必须去做。
2、可以。所不同的是,仿制药的前期研发成本低于原研药。可以豁免药物临床试验,并且质量、疗效与原研药一致,可以较低的价格、较大的产量进入药品市场。
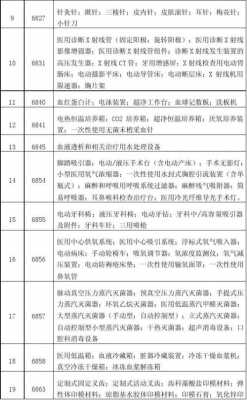
3、豁免是做了和方案要求的事情被批准继续进行临床研究。
4、【答案】:A、B、C 考查仿制药注册要求。选项D属于仿制药,一般需要进行临床试验,至少进行Ⅲ期临床试验。选项A、选项B和选项C可以不用进行临床试验,但是需要进行非临床研究,然后直接申请上市。故答案为ABC。
5、对于列入《免于进行临床试验的医疗器械目录》(以下简称《目录》产品,注册申请人需提交申报产品相关信息与《目录》所述内容的对比资料和申报产品与已获准境内注册的《目录》中医疗器械的对比说明。
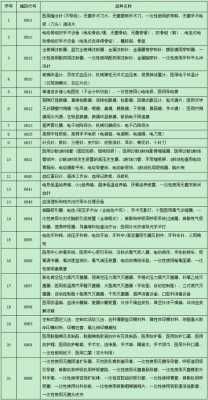
6、《办法2020》明确了三种申请药品上市许可的路径:一是完整路径,即完成支持药品上市注册的药学、药理毒理学和药物临床试验等研究,确定质量标准,完成商业规模生产工艺验证后完整的申报路径。
医保目录内和医保目录外是什么意思
1、目录内费用:医保可以报销,一般简称为 “社保内费用”。目录外费用:医保不报销,例如一些新上市的抗癌药、进口药等,需要自己掏钱。
2、医保目录内外的意思:医保目录内是指我们去医院看病花的钱,医保可以报销,一般简称为 “社保内费用”;医保目录外是指我们去医院看病花的钱,医保不报销,例如一些新上市的抗癌药、进口药等,需要自己掏钱。
3、医保目录内与目录外的区别 【1】目录内费用:医保可以报销,一般简称为“社保内费用”。 【2】目录外费用:医保不报销,例如一些新上市的抗癌药、进口药,很贵的创新药、专利药等,需要自己掏钱。
4、医保目录内与目录外就是指医保目录内的医疗费用可以使用基本医保进行报销。
5、医保内和医保外区别如下:医保内是指在住院时医院用的各种药和各种捡查费用可以用医保报销的;医保外是指在往院时用的药或其他费用不在医保报销范围内,不能用医保报销的,也就是这些费用要全自费的。
6、而医保外则是指不在医保目录内的药品和诊疗项目,这部分费用需要患者自己承担。医疗设施的范围:医保内是指患者在接受诊断、治疗和护理过程中必须的服务设施,比如定点医疗机构提供的服务设施,这部分费用是在医保范围内的。
二类医疗器械需要临床试用报告,什么情况下可以免除?
需要,但是如果如何规定也可以不做。《医疗器械注册管理办法》第二十二条 办理第一类医疗器械备案,不需进行临床试验。申请第二类、第三类医疗器械注册,应当进行临床试验。
豁免是做了和方案要求的事情被批准继续进行临床研究。
除了三类一定要之外,二类大部分是不用的,具体情况在于你的产品。
逾期的话是需要重新注册才行的,临床这方面,如果你产品注册证未逾期之前产品未出现医疗事故,产品的特性,性质未曾改变的。那么你可以拿以前的临床报告去申请临床豁免。以上信息由“盖世骏宝”为你提供。
一般来说,豁免报告可以通过如下方式:列入目录品种范围的第二类医疗器械申报产品注册时,申请企业可书面申请免于提交临床试验申请,同时提交申报品种与已上市同类产品的对比说明。
豁免是怎么回事
1、保费豁免是指在保险合同规定的缴费期内,被保险人或者投保人出现了某一种合同约定的状况如身故、轻症、重疾之后,可以豁免保单后续所有的保费,而保险合同还继续有效。保费豁免分为被保险人豁免和投保人豁免两种。
2、保费豁免是指在保险合同规定的缴费期内,投保人或被保险人达到某种特定情况,如患轻症、重疾、身故等,后续的保费就可以不用再缴纳,但保障依然继续。保费豁免目前分两种:投保人豁免和被保人豁免。
3、豁免分为投保豁免和被保人豁免,也就是投保人/被保人发生合同规定的疾病、全残、身故等情形,保险公司将豁免余下各期的应交保险费。
4、保费豁免是指在保险合同规定的缴费期内,当投保人或被保人发生约定的事故,如身故、轻症、重疾等,之后可以不再交剩下的保费,但仍享有原来的保障。保费豁免一般分为两种,分别是被保人豁免和投保人豁免。
在临床试验豁免目录里的临床资料怎么写
一般来说,豁免报告可以通过如下方式:列入目录品种范围的第二类医疗器械申报产品注册时,申请企业可书面申请免于提交临床试验申请,同时提交申报品种与已上市同类产品的对比说明。
资料至少应包括伦理委员会意见、临床试验方案和临床试验报告,申请人还需提交论证产品临床性能和/或安全性是否存在人种差异的相关支持性资料。
临床评价应全面、客观,应通过临床试验等多种手段收集相应数据,临床评价过程中收集的临床性能和安全性数据、有利的和不利的数据均应纳入分析。
临床表现:起病急缓不一,病人常有贫血、出血、感染、各种器官浸润表现。(1)贫血往往是首起表现,呈进行性发展,主要由于正常RBC生成减少。(2)发热可低热,亦可高达39~40℃以上,伴有畏寒、出汗等。
(十二)副作用预测及应当采取的措施;(十三)受试者《知情同意书》;(十四)各方职责。医疗机构与实施者签署双方同意的临床试验方案,并签订临床试验合同。医疗器械临床试验应当在两家以上(含两家)医疗机构进行。
临床研究资料手册主要用作: 1.给研究负责人提供所有有关被试药物的信息及研究结果。 2.作为受试药物已获得正式核准的标志。 3.包括所有最新的对受试药物所作研究的总结,这可用于新药临床试验或药物上市许可证的申请。
到此,以上就是小编对于豁免临床试验目录的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏