接下来,给各位带来的是fda诊断试剂申报资料的相关解答,其中也会对fda试剂盒进行详细解释,假如帮助到您,别忘了关注本站哦!
生产试剂盒需要什么资质
与口罩类似,生产单位一样需要提供《医疗器械生产许可证》。新型冠状病毒检测试剂盒须取得《中华人民共和国医疗器械注册证》。 《医疗器械经营许可证》 对于出口该产品的外贸经营单位须取得《医疗器械经营许可证》。

需要两类资格证:生产企业资质:营业执照(三证合一)组织机构代码证,完税证明生产许可证产品注册证生产企业资质:营业执照(三证合一)组织机构代码证,完税证明生产许可证授权连完整进货协议。
工商营业执照,税务登记证,工业产品生产许可证,涉及危险化学品的还要有危险化学品生产许可证,安全生产许可证。
冠检测试剂盒属于三类医疗器械的体外诊断试剂类别经营三类医疗器械不同于一类和二类,经营一类医疗器械只需具备营业执照即可,经营二类医疗器械需要到药监局进行备案,而经营三类医疗器械则需要办理《医疗器械经营许可证》。
级。向抗原试剂盒生产需要2级资质。新冠抗原检测试剂盒从原理上讲其实是侧向免疫层析的具体应用,只不过根据显色材料的不同,又进一步分为胶体金免疫层析、乳胶免疫层析两种。

体外诊断试剂注册与备案管理办法
1、第一章 总 则第一条 为了规范体外诊断试剂注册与备案行为,保证体外诊断试剂的安全、有效和质量可控,根据《医疗器械监督管理条例》,制定本办法。
2、第四条 体外诊断试剂注册是食品药品监督管理部门根据注册申请人的申请,依照法定程序,对其拟上市体外诊断试剂的安全性、有效性研究及其结果进行系统评价,以决定是否同意其申请的过程。
3、体外诊断试剂:办公面积不少于60平,仓库面积不少于100平,冷藏室面积不少于40立方 人员要求:三名本科学历相关医疗行业。
美国fda医疗器械认证定义?
美国FDA对医疗器械定义如下:所谓医疗器械是指符合以下条件之仪器、设备、器具、机器、用具、植入物、体外试剂及其它相似或相关物品,包括零部件或配件。
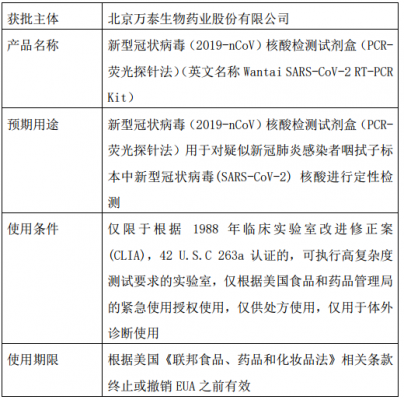
FDA认证,全称为“美国食品药品监督管理局认证”,是美国政府机构负责确保食品、药品、医疗器械和化妆品等产品的质量、安全和有效性。FDA认证是基于美国联邦法律和法规的规定,旨在保护公众健康,确保产品的合规性和安全性。
FDA是美国食品和药物管理局的简称。FDA认证主要指以下两种:FDA注册:很多产品销售到美国需要的进行注册的(如食品,药品,医疗器械,激光产品等),有些产品还必须要做过检测才能申请注册。
北京市的第二类体外诊断试剂注册需要提交什么资料
1、以及与经营的医疗器械相适应的质量管理制度和质量管理机构或者人员。第三十条规定 从事第二类医疗器械经营的,由经营企业向所在地设区的市级人民政府食品药品监督管理部门备案并提交其符合本条例第二十九条规定条件的证明资料。
2、提交材料之后,食品药品监督管理部门会当场对企业提交资料的完整性进行核对,申请材料齐全且符合法定形式,则接受备案资料,并发给企业第二类医疗器械经营备案凭证。
3、第二类零售企业可以不设置库房。 经营体外诊断试剂批发还应设置不得小于20立方米容积的冷库。
到此,以上就是小编对于fda试剂盒的问题就介绍到这了,希望介绍的几点解答对大家有用,有任何问题和不懂的,欢迎各位老师在评论区讨论,给我留言。

 微信扫一扫打赏
微信扫一扫打赏